水を知る4:水を構成する水素と酸素3
- 2012/02/07 16:39
- Category: 水の科学
前回の記事では、「電子の偏りを「極性」と呼び、水の性質を考える上で非常に重要なキーワードになります。」との言葉で締めました。酸素原子が電子を引っ張る力が強いために、水素原子が引っ張られ、電子の偏りが生じる「極性」。この極性によって生じる影響は、水分子の中だけにとどまりません。
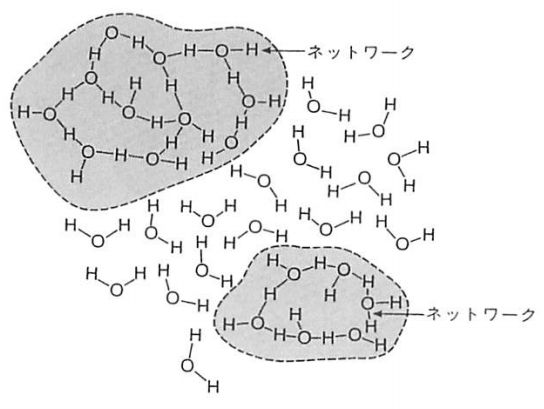
いかなる状況に置いても1つの水分子が単独で成立することはあり得ません。目の前のコップに入っている水には、アボガドロ数程度の水分子がひしめき合っている状態です。つまり、1つの水分子が所有している「極性」は、他の水分子に影響を与えることになります。具体的に言うと、1つの水分子(Aとします)の水素原子が、別の水分子(Bとします)の酸素原子に近づく時、両者の間で弱い結合を引き起こすことになります。この結合を水素結合といいます。水分子内の水素原始と酸素原子をくっつけている共有結合のエネルギーが110kcal/molであるのに対し、AとBを結びつける水素結合は4.5kcal/molであり、共有結合と比べると圧倒的に弱いことが分かります。水分子は常に熱エネルギーによって動いているので、水素結合によって生じる結合は生じても、一瞬で離れます。それでも、水中のいたるところで「くっついたり・離れたり」が生じているため、瞬間的に近接している水分子がグループを組んでいるように水素結合で結びついていることがあります。これを水のクラスターと言います。クラスターは水の性質を考える上でとても重要なキーワードです。
画像/参考書籍:H2Oの生命科学―細胞生命のしくみ(著:中村 運)
参考書籍:水の書 (PNEモノグラフ)(著:荒田 洋治)